Her Zamankinden
Daha Sağlıklı
Her Zamankinden
Daha Hızlı






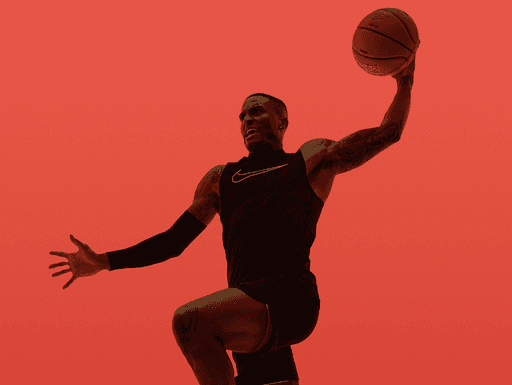








Daha sağlıklı bir yaşam için her an bir fırsat, En iyilerden oluşan ekibimizle yaşam kalitenizi arttırmak için çalışıyoruz
Daha sağlıklı bir yaşam için her an bir fırsat, En iyilerden oluşan ekibimizle yaşam kalitenizi arttırmak için çalışıyoruz
Branşa özel patlayıcı güç odaklı egzersizlerle hedeflerinizde yol arkadaşınız bilim ve teknoloji olacak
RANDEVU OLUŞTUR
Her Zamankinden
Daha Hızlı
Her Zamankinden
Daha Sağlıklı












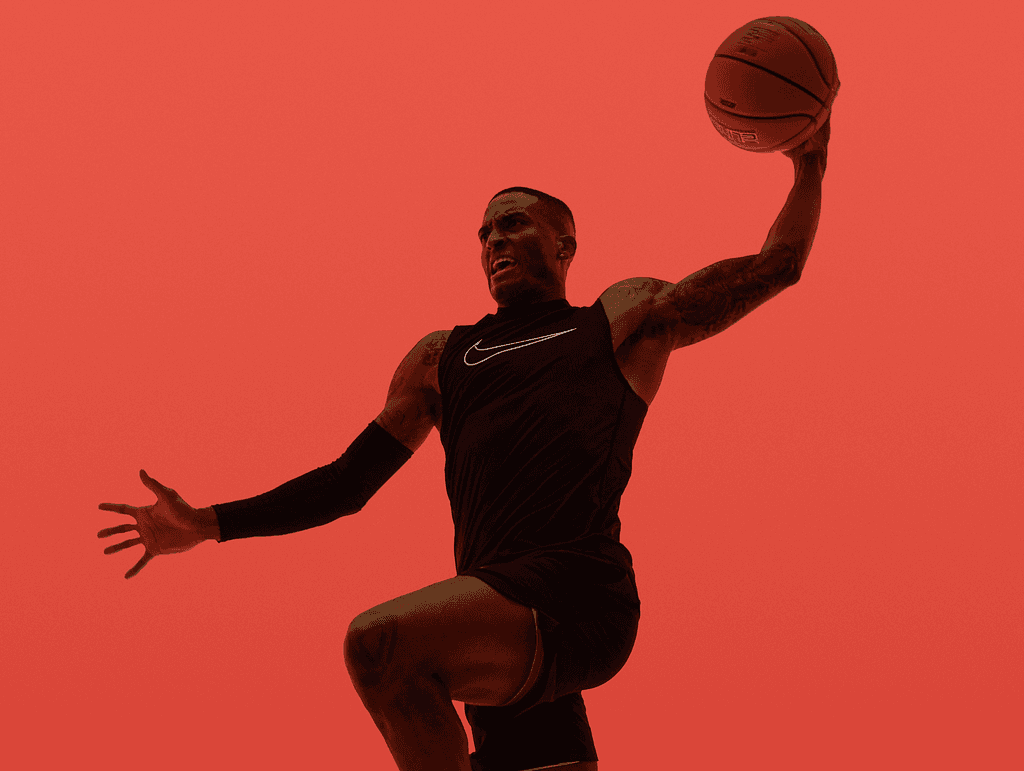
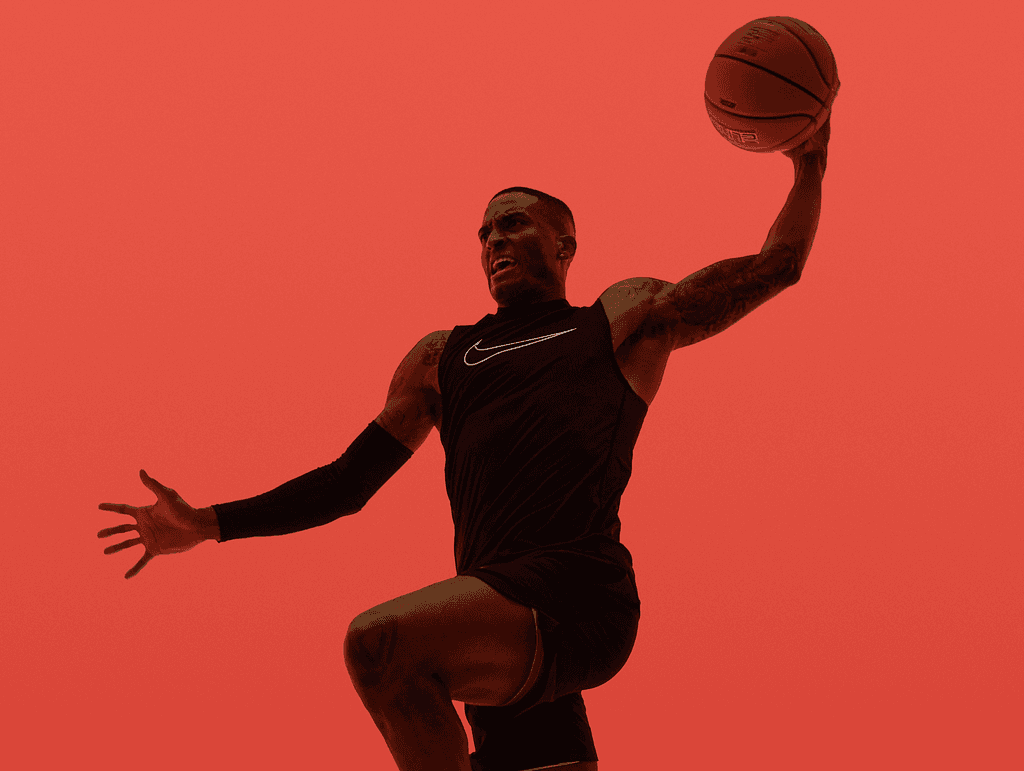
Branşa özel patlayıcı güç odaklı egzersizlerle hedeflerinizde yol arkadaşınız bilim ve teknoloji olacak
Daha sağlıklı bir yaşam için her an bir fırsat, En iyilerden oluşan ekibimizle yaşam kalitenizi arttırmak için çalışıyoruz
RANDEVU OLUŞTUR
Her Zamankinden
Daha Dayanıklı
Her Zamankinden
Daha Dayanıklı













Sakatlanma riskini minimize eden egzersiz yöntemleri ile sağlıklı ve sürdürülebilir fizikler yaratırken potansiyeli maksimuma çıkarmayı hedefliyoruz
Sakatlanma riskini minimize eden egzersiz yöntemleri ile sağlıklı ve sürdürülebilir fizikler yaratırken potansiyeli maksimuma çıkarmayı hedefliyoruz
RANDEVU OLUŞTUR
Kronik ağrıyı ortadan kaldırın
Functional Patterns™
kalıcı rahatlama ile güce giden yol
Kronik ağrıyı ortadan kaldırın
Functional Patterns™
kalıcı rahatlama ile güce giden yol
Kronik ağrıyı ortadan kaldırın
Functional Patterns™
kalıcı rahatlama ile güce giden yol
Functional Patterns, modern yaşamın neden olduğu hareketsizlik ve biyomekanik dengesizlikleri çözmeyi amaçlayan, yenilikçi bir antrenman sistemi sunuyor. Sistem, insanların hareket yeteneklerini geliştirerek kronik ağrılardan kurtulmalarına, duruşlarını düzeltmelerine ve kas güçlerini artırmalarına odaklanır.
Functional Patterns, modern yaşamın neden olduğu hareketsizlik ve biyomekanik dengesizlikleri çözmeyi amaçlayan, yenilikçi bir antrenman sistemi sunuyor. Sistem, insanların hareket yeteneklerini geliştirerek kronik ağrılardan kurtulmalarına, duruşlarını düzeltmelerine ve kas güçlerini artırmalarına odaklanır.
Functional Patterns, modern yaşamın neden olduğu hareketsizlik ve biyomekanik dengesizlikleri çözmeyi amaçlayan, yenilikçi bir antrenman sistemi sunuyor. Sistem, insanların hareket yeteneklerini geliştirerek kronik ağrılardan kurtulmalarına, duruşlarını düzeltmelerine ve kas güçlerini artırmalarına odaklanır.
DAHA FAZLASI

Gelişmelerden haberdar olmak için
bültenimize kayıt olun
Gelişmelerden
haberdar olmak için
bültenimize kayıt olun
Güncel kalmak için aylık bültenimize kaydolun.
Gelilşmelerden
haberdar Olmak İçin
bültenimize kayıt olun


Güncel kalmak için aylık bültenimize kaydolun.
© 2024 – Fizyo Aktif Powered by Culture Creative
FizyoAktif olarak, kullanıcılarımızın gizliliğine büyük önem veriyoruz. Bu Gizlilik Politikası, web sitemizi kullandığınızda kişisel verilerinizin nasıl toplandığını, kullanıldığını, korunduğunu ve paylaşıldığını açıklamaktadır. Sağlık verileri gibi hassas bilgilerin korunması, yasal gerekliliklere ve etik standartlara uygun olarak yapılmaktadır.
© 2024 – Fizyo Aktif Powered by Culture Creative
FizyoAktif olarak, kullanıcılarımızın gizliliğine büyük önem veriyoruz. Bu Gizlilik Politikası, web sitemizi kullandığınızda kişisel verilerinizin nasıl toplandığını, kullanıldığını, korunduğunu ve paylaşıldığını açıklamaktadır. Sağlık verileri gibi hassas bilgilerin korunması, yasal gerekliliklere ve etik standartlara uygun olarak yapılmaktadır.
© 2024 – Fizyo Aktif Powered by Culture Creative
FizyoAktif olarak, kullanıcılarımızın gizliliğine büyük önem veriyoruz. Bu Gizlilik Politikası, web sitemizi kullandığınızda kişisel verilerinizin nasıl toplandığını, kullanıldığını, korunduğunu ve paylaşıldığını açıklamaktadır. Sağlık verileri gibi hassas bilgilerin korunması, yasal gerekliliklere ve etik standartlara uygun olarak yapılmaktadır.
© 2024 – Fizyo Aktif Powered by Culture Creative
FizyoAktif olarak, kullanıcılarımızın gizliliğine büyük önem veriyoruz. Bu Gizlilik Politikası, web sitemizi kullandığınızda kişisel verilerinizin nasıl toplandığını, kullanıldığını, korunduğunu ve paylaşıldığını açıklamaktadır. Sağlık verileri gibi hassas bilgilerin korunması, yasal gerekliliklere ve etik standartlara uygun olarak yapılmaktadır.
